 | ||
 | ||
 | ||
 | ||
Наша клетка - особый мир, состоящий не из беспорядочно плавающих молекул,
а из сложных молекулярных механизмов. Важнейшей молекулой этого
микрокосма является ДНК (дезоксирибонуклеиновая кислота).
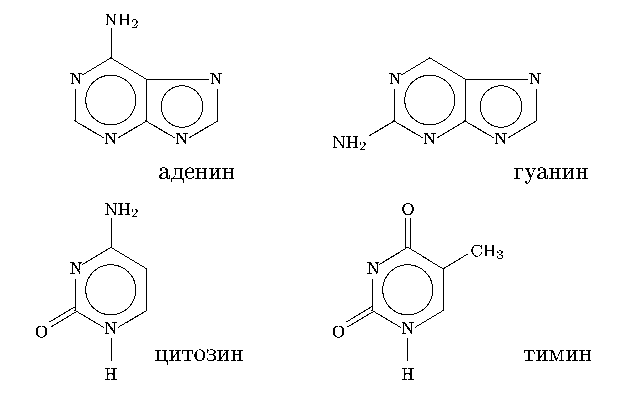
Это двуспиральная полимерная молекула, представляющая из себя последовательно
соединенные нуклеотиды - фрагменты, состоящие из остатка фосфорной кислоты,
углевода (дезоксирибозы) и одного из азотистых оснований (АО):
аденина, гуанина, цитозина или тимина.
За последние пятьдесят лет, прошедших с момента открытия двутяжевой структуры ДНК, все более остро встает проблема секвенирования этой молекулы, т.е. установления последовательности нуклеотидов в ней. В связи с этим перед проектом "Микрокосм" была поставлена задача создать метод, позволяющий расшифровать ДНК.
Существующие методы получения ДНК очень сложны и дорогостоящи,
а для исследований необходимо большое количество образца. Это
ставит перед учеными задачу увеличения числа необходимых фрагментов
ДНК с максимальным выходом. Самый популярный на сегодняшний день метод -
полимерная цепная реакция (ПЦР, изобретение Кэри Муллис,
отмеченное в 1993 году Нобелевской премией). Известно, что ДНК способна
к ренатурации - восстановлению утраченной в результате нагревания
двутяжевой структуры при медленном охлаждении.
На этом факте и основан метод.
Предположим, в ДНК имеется фрагмент, который требуется скопировать
(рис. 1).
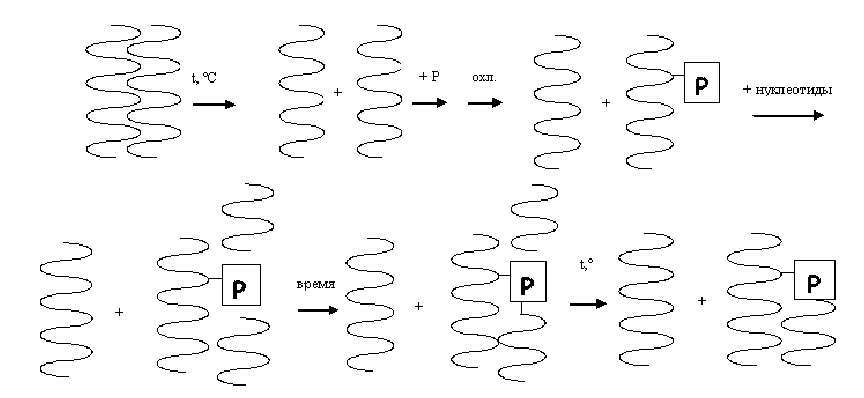
Для этого в раствор помещается молекула ДНК и нагревается до 90 , при этом она распадается на отдельные цепи. В раствор добавляется праймер - ограниченная с одного конца (3- или 5-) последовательность нуклеотидов, комплиментарная одному из концов нужного фрагмента. Она должна быть достаточно длинной, чтобы исключить вероятность повторения комплиментарного ей фрагмента более одного раза, но достаточно короткой, чтобы ренатурация с праймером происходила быстро. При постепенном охлаждении праймер и соответствующая цепь ДНК закручиваются в двойную спираль, причем за время, резко недостаточное для закручивания всей ДНК, что вызвано малым размером праймера. Далее в раствор запускаются нуклеотиды, которые без дополнительного нагревания присоединяются к комплиментарным им нуклеотидам в ДНК. Их количество должно превосходить рассчитанное в тысячи раз из-за низкого выхода этого процесса. По прошествии времени они соединяются друг с другом, образуя две цепи, одна из которых находится с незаблокированной стороны праймера, вследствие чего присоединяется к нему.
Таким образом, мы получили фрагмент исходной ДНК, ограниченный с одного конца. Повторяя изложенные действия с полученной последовательностью, мы получим требуемый участок. Количество необходимых фрагментов ДНК, получаемых за n циклов, равно m(2n-2n), где m - число исходно взятых ДНК.
Перейдем к решению основной задачи - секвенирования ДНК. Нами были разработаны два метода. Первый из них не требует компьютерной реализации и заключается в следующем.
Синтезируем нуклеотиды с "мечеными" азотистыми основаниями: например, заменим в аденине один из азотов на N15, в гуанине C12 на C13, в тимине O16 на O17 и в цитозине H1 на H2. Все нуклеотиды заблокируем с одного конца (например, 3-) и запустим в раствор, содержащий одноцепочечную ДНК (получить ее можно, запустив при ПЦР в раствор праймеры, комплиментарные только одной спирали). Затем добавляем в раствор нерадиоактивные нуклеотиды и ждем, пока они присоединятся сначала к комплиментарным АО из ДНК, а затем соединяются между собой.
При дальнейшем нагревании вновь полученные последовательности нуклеотидов
отрываются. Далее разгоняя эту смесь по массам в электрофорезе
(рис. 2), мы получаем набор "хвостов", характеризующихся

Таким образом, зная характер радиоактивности каждого фрагмента и их порядок, мы последовательно получим:
Один из основных недостатков метода - невозможность разделения тяжелых нуклеотидных последовательностей, т.к. в процентном соотношении различие между их массами очень невелико. И если определить начальные и конечные нуклеотиды можно, блокируя меченые нуклеотиды последовательно с 3- и 5- концов, то трудностей с определением среднего участка ДНК избежать не удастся.
Этот метод также основан на спообности всей ДНК и ее частей к ренатурации. В результате исследования для каждой последовательности нуклеотидов длины n извесно ее наличие или отсутствие в данной ДНК. Метод реализуется следующим образом.
На подложку крепятся все возможные последовательности нуклеотидов длины n в известном порядке (например, для n=3 таких последовательностей будет 43=64 и их удобно расположить 8×8). Подложка помещается в раствор, в который, кроме того, помещается вещество, способное к люминесценции тогда и только тогда, когда оно находится внутри двойной спирали ДНК. В этот же раствор помещается одноцепочечная ДНК. При нагревании до 90 и последующего охлаждения исследуемая спираль ренатурирует с теми "хвостами", которые комплиментарны какому-нибудь фрагменту ДНК. Внутри образованных двойных спиралей начинает светиться люминесцент, что и можно наблюдать. Таким образом, для каждой последовательности нам известно, светится ли тот участок подложки, к которому она прикреплена → существут ли в ДНК комплиментарный ей участок.
Недостаток метода - сложность определения величины n: чем меньше ее значение, тем больше различных ДНК может удовлетворять поставленным условиям, т.е. усложняется послеующая обработка результатов (нужно выбрать из сотен вариантов единственно верный). Одновременно увеличение длины цепи влечет трудность ее синтеза: такие фрагменты получают в растворе непосредственно из нуклеотидов и сложность разделения образовавшейся смеси коррелирует с длиной необходимого фрагмента.
Этот метод требует дальнейшей компьютерной реализации. Из-за недостатка времени не была созана универсальная программа, способная по информации о наличии и отсутствии нуклеотидных последовательностей выдавать все возможные варианты ДНК, однако программа способна отсеивать неверные данные (которые не могут соответствовать ни одной молекуле) и решать небольшие последовательности нуклеотидов.